Ionengitter Chemie Fur Mediziner Chemische Bindung Chemgapedia / ionengitter ionenkristall
Was ist Gitterenergie? Die Gitterenergie (Gitterdissoziationsenergie) ist die Energie, um ein Ionengitter zu zerlegen und Ionen in gasförmigen Zustand zu bringen. Die Einheit ist kJ/mol. Was ist der Unterschied zwischen Gitterenergie und Gitterenthalpie?

Gitterstrukturen sehr einfach erklärt 1a Technikermathe
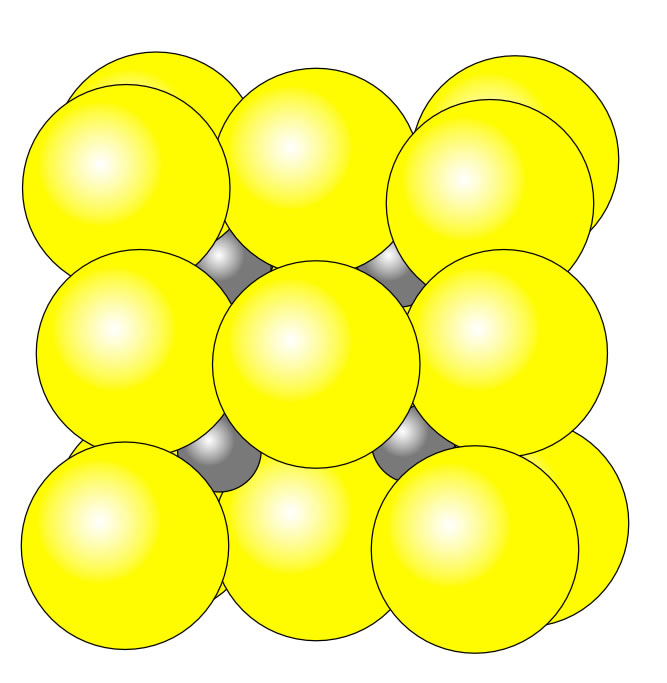
Ein Ionengitter ist eine gleichmäßige Aufstellung, die aus positiv (Kationen) und negativ (Anionen) geladenen Ionen besteht. Durch ihre entgegengesetzten Ladungen ziehen sie sich gegenseitig an und bilden eine Struktur, die wie ein Gitter aussieht: das Ionengitter.
Referat Die Ionenbindung
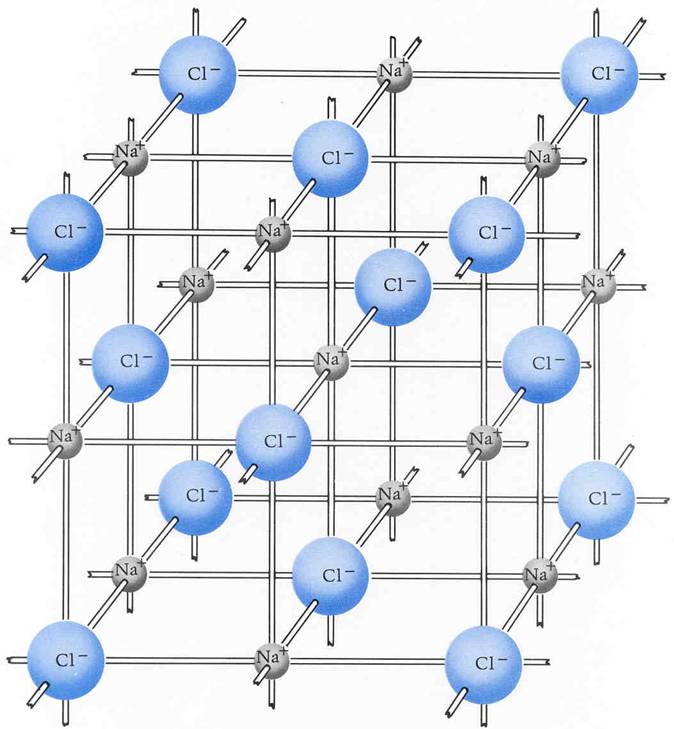
Die Lehre der Kristalle nennt man Kristallographie. Erklärung anhand des Kochsalzgitters (ein Ionengitter) Ionengitter: Regelmäßige Anordnung von Ionen in einem Kristall Kochsalz ( Natriumchlorid) besteht aus Natriumionen (Na+ positiv geladen) und Chloridionen (Cl-, negativ geladen).
Ionengitter Chemie Fur Mediziner Chemische Bindung Chemgapedia / ionengitter ionenkristall
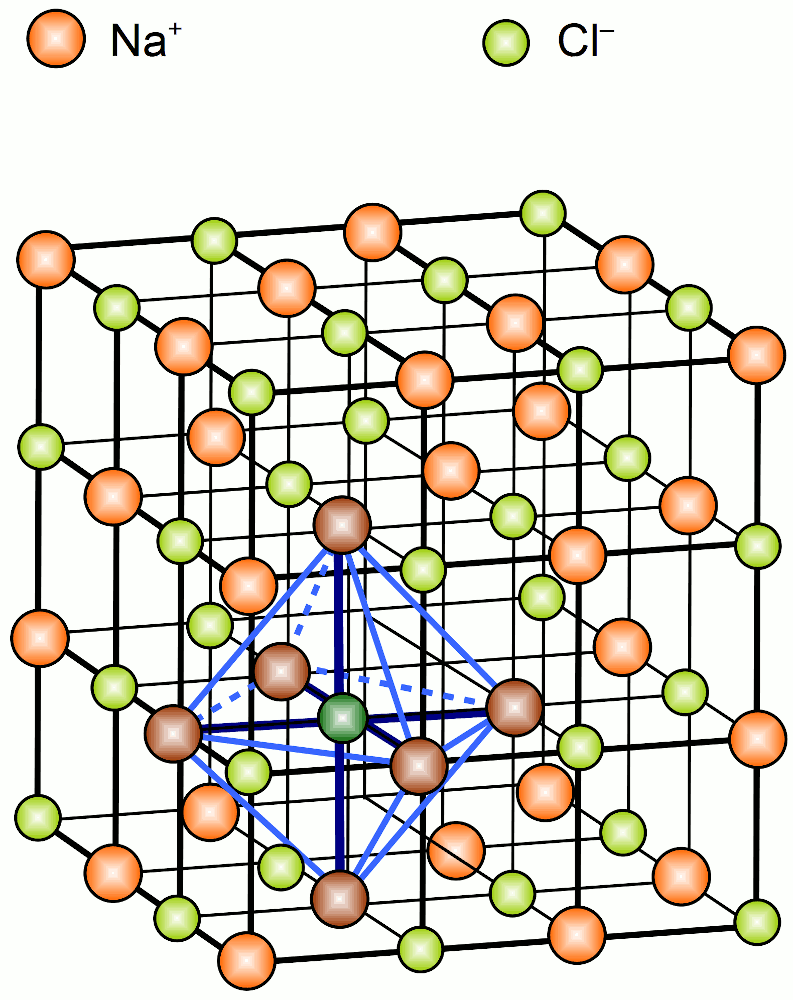
Unter einem Ionenkristall oder Ionengitter versteht man in der Chemie und der Festkörperphysik die regelmäßige räumliche Anordnung von Anionen und Kationen eines homogenen Stoffes im festen Zustand. Der Zusammenhalt des Gitterverbandes erfolgt durch die Ionenbindung.
Ionenbindung lernen mit Serlo!
Eine Ionenbindung ist eine elektrostatische Wechselwirkung zwischen Ionen. Das bedeutet, dass sich Ionen, also Kationen und Anionen, gegenseitig anziehen. Die Ionenbindung ist die stärkste Bindung, die zwischen Teilchen herrschen kann. Erfüllung der Oktettregel Alle Atome wollen die Oktettregel erfüllen.

IonenbindungIonenKationen und Anionen YouTube
Was ist eine Ionenbindung? Eine Ionenbindung ist eine chemische Bindung, die durch die Anziehung von positiv geladenen Ionen (Kationen) und negativ geladenen Ionen (Anionen) entsteht. Diese entsteht, wenn ein Atom Elektronen an ein anderes Atom abgibt oder aufnimmt, um eine stabile Elektronenkonfiguration zu erreichen. 2.
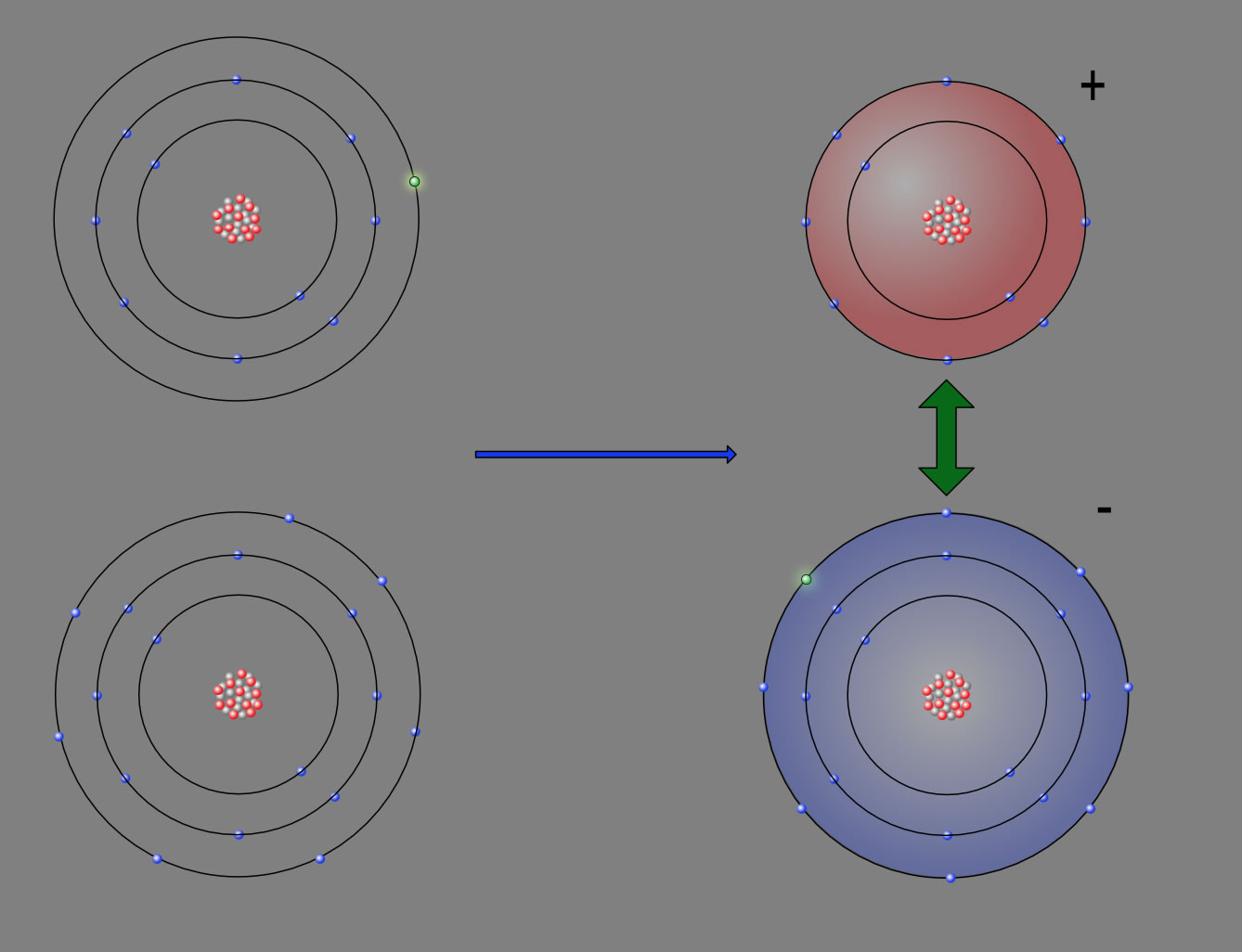
Die Ionenbindung
Unter einem Ionengitter versteht man in der Physik und Chemie die regelmäßige räumliche Anordnung von Kationen und Anionen in einem homogenen Feststoff. Der Zusammenhang innerhalb des Gitterverbandes wird durch ungerichtete Ionenbindungen gewährleistet.

Kann mir jemand die Ionenbildung erklären (evtl mit Beispiel)? (Schule, Chemie, Ionen)
Unter einem Ionengitter oder Ionenkristall versteht man in der Chemie und der Festkörperphysik die regelmäßige räumliche Anordnung von Anionen und Kationen in einem homogenen Stoff im festen Zustand. Der Zusammenhalt des Gitterverbandes erfolgt durch Ionenbindungen.
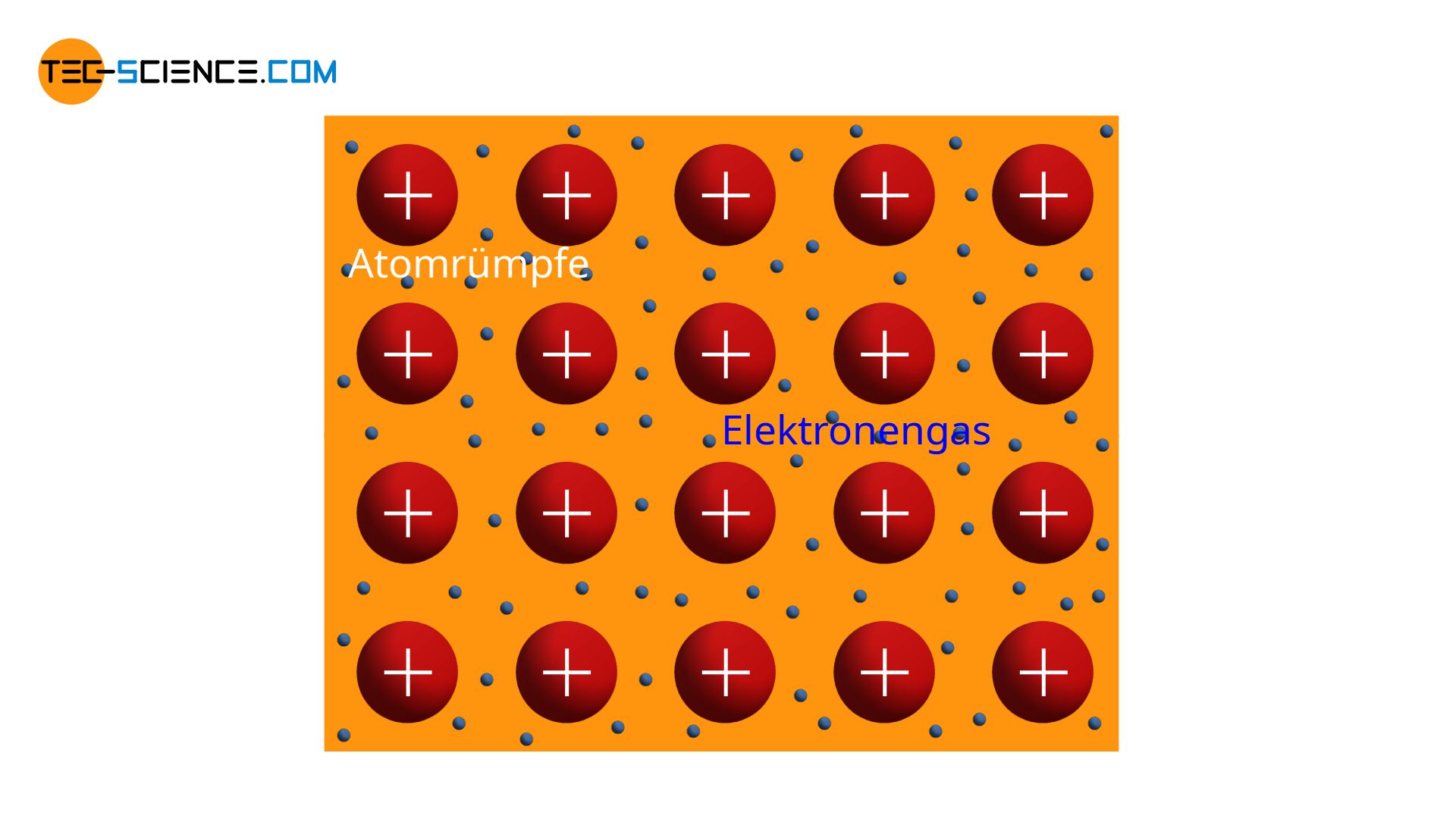
Gitterstruktur von Metallen tecscience
Chemische Bindung. Unter einem Ionenkristall oder Ionengitter versteht man in der Chemie und der Festkörperphysik die regelmäßige räumliche Anordnung von Anionen und Kationen eines homogenen Stoffes im festen Zustand. Der Zusammenhalt des Gitterverbandes erfolgt durch die Ionenbindung.
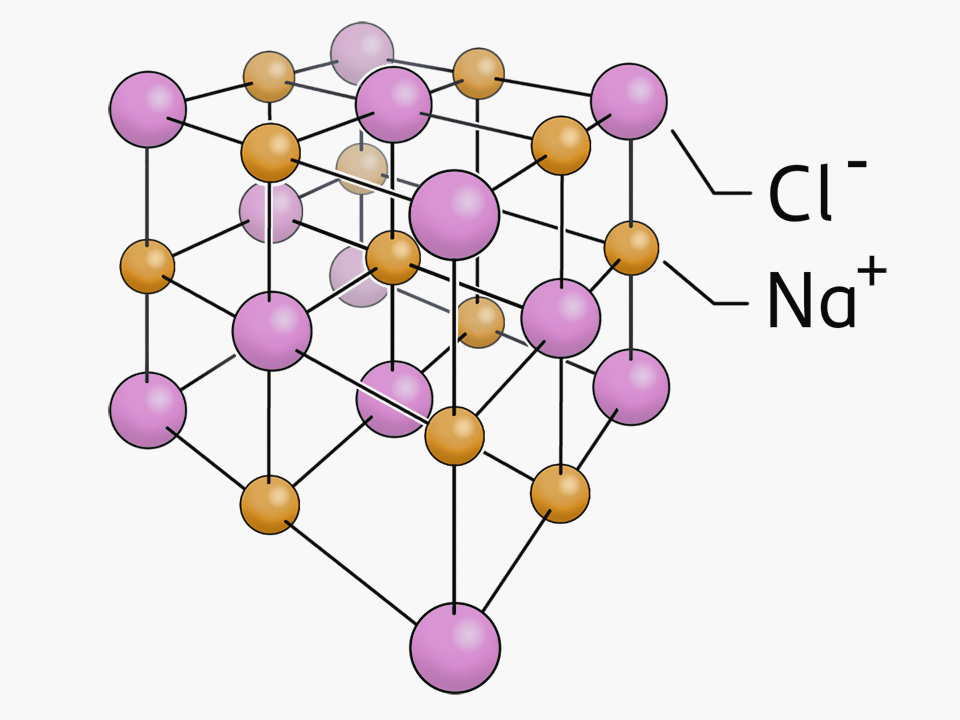
Ionengitter / KATIONEN UND ANIONEN Chemie Verbindungen
Ionengitter - was ist das? Bei Bindungen streben Atome danach, ein sog. Elektronenoktett, auch Edelgaskonfiguration genannt, anzustreben. Viele chemische Verbindungen sind dabei durch Elektronenübergänge gekennzeichnet, sprich ein oder mehrere Elektronen werden von einem Reaktionspartner an den anderen abgegeben.
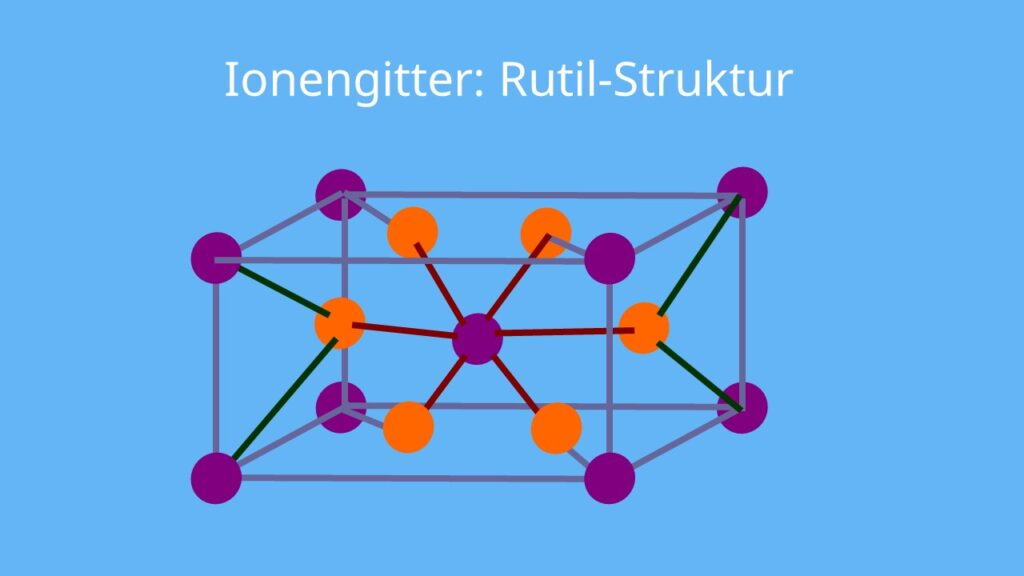
Ionengitter • einfach erklärt, Eigenschaften und Beispiele · [mit Video]
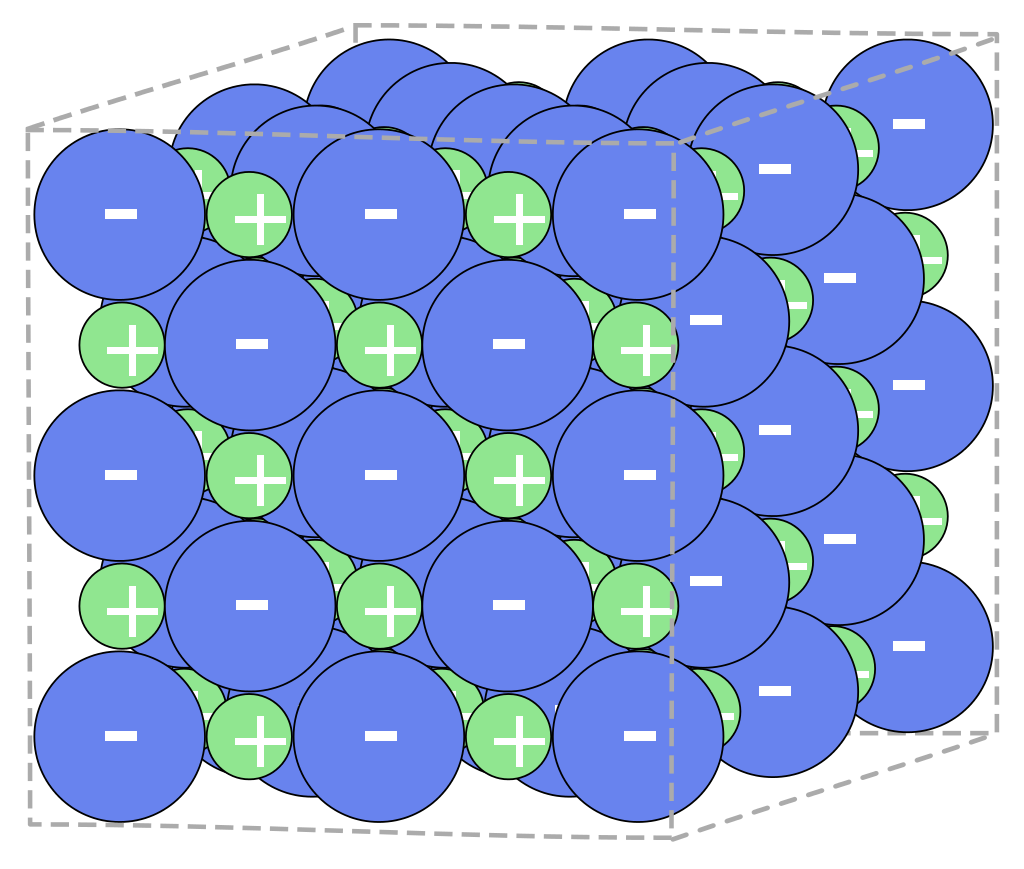
Ein Ionengitter ist die regelmäßige Anordnung von negativ geladenen Anionen und positiv geladenen Kationen. Das Ionengitter wird von Ionenbindungen zusammengehalten. Bildung eines Ionengitters Damit Atome die Oktettregel erfüllen, bilden sie Ionen. Es gibt zwei verschiedene Arten: die Kationen und die Anionen.
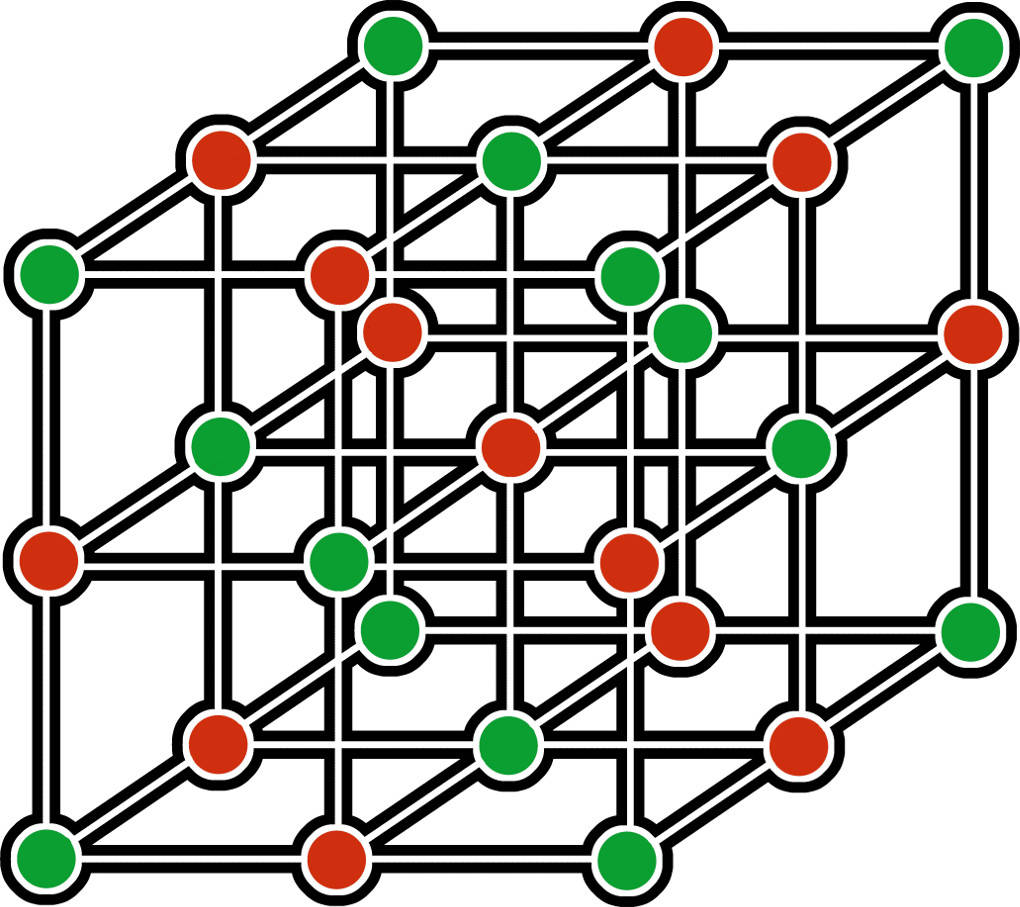
Salze Eigenschaften und Bildung online lernen
Unter einem Ionengitter oder Ionenkristall versteht man in der Chemie und der Festkörperphysik die regelmäßige räumliche Anordnung von Anionen und Kationen in einem homogenen Stoff im festen Zustand. Der Zusammenhalt des Gitterverbandes erfolgt durch Ionenbindungen.

Pin auf Learning Level Up Lernvideos
Eine Metallbindung (auch metallische Bindung oder ungerichtete Bindung) ist eine Bindung von Metallen, die ihre Valenzelektronen zur Verfügung stellen und somit ein Elektronengas bilden. Das Elektronengas kann von allen beteiligten Metallatomen genutzt werden, um die Edelgaskonfiguration zu erreichen.
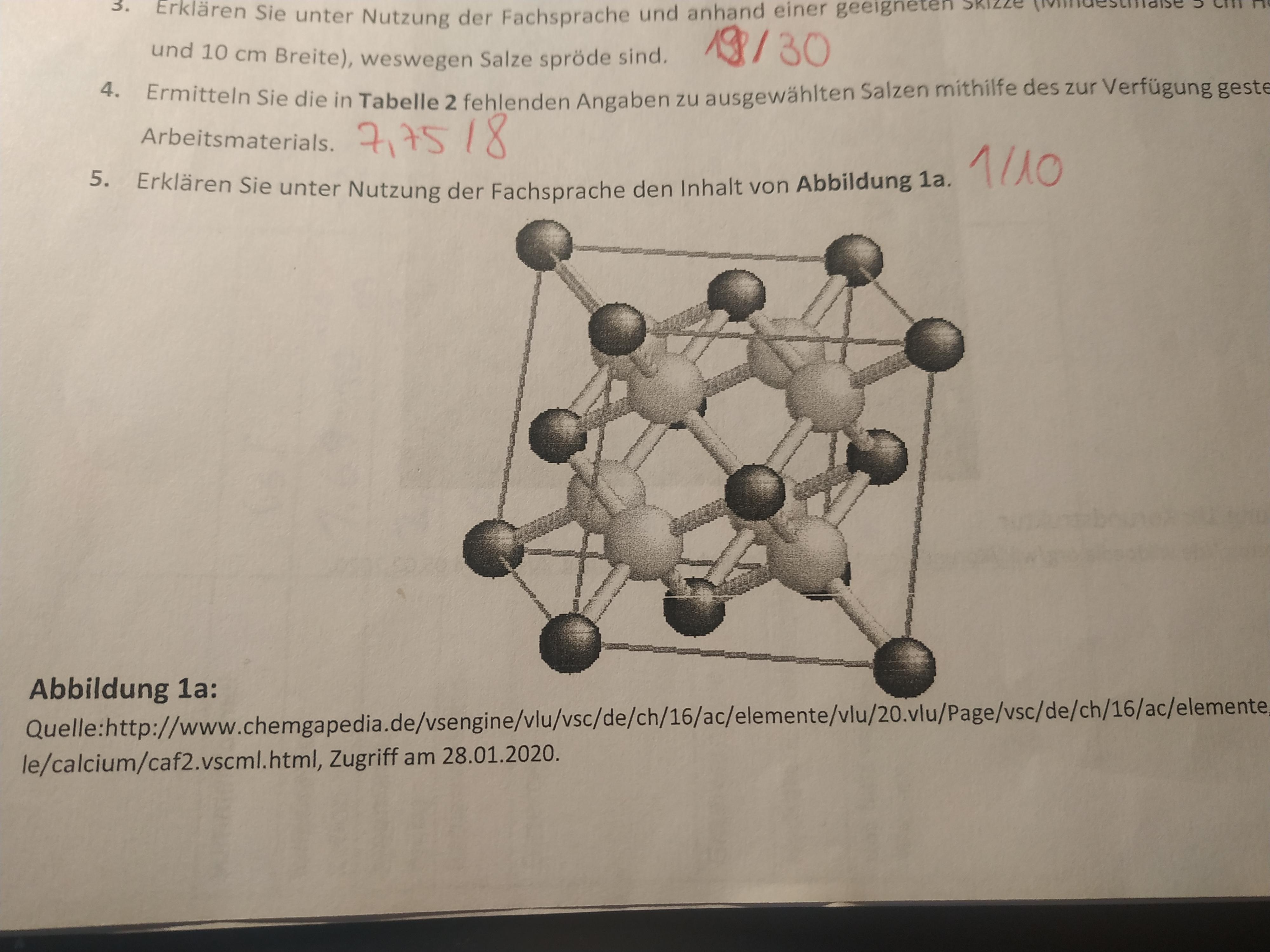
Ionengitter / Salze Und Ionengitter Erklart Inkl Ubungen Ionen bilden einen festen ionenverband
Die Definition eines Ionengitters Ein Ionengitter liegt nun vor, wenn sich die Ionen innerhalb des Stoffes gitterförmig anordnen. Ionen - eine einfache Erklärung aus der Physik lonen sind essentielle Bestandteile der Physik und der Chemie. Es handelt sich um geladene.

1.3.2 Ionenbindung _main.utf8
Erklärung der Größe. Die Gitterenergie gibt an, wie viel Energie man benötigt, um ein Ionengitter aufzuspalten und anschließend die einzelnen Ionen in den gasförmigen Aggregatzustand zu bringen. Die Gitterenergie wird in Kilojoule je Mol \frac {\text {kJ}} {\text {mol}} molkJ angegeben. Es wird also angegeben, wie viel Kilojoule Energie.
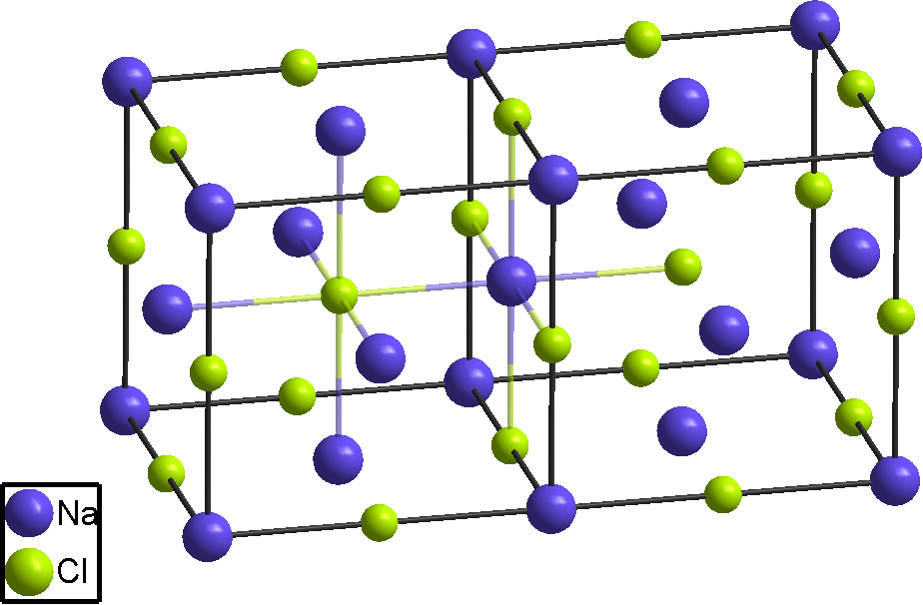
Wichtige Salze und ihre Bedeutung online lernen
Bildung des Ionengitters. Wenn sich Ionen verbinden,entsteht ein Ionengitter, da sich die gleichgeladenen Ionen abstossen und die gegengleichgeladenen Ionen anziehen. Somit ist die Bildung des Ionengitters eigentlich eine Optimierung, denn die gleichgeladenen Ionen versuchen möglichst weit voneinander entfernt zu sein, während die.